PROTEİNLER
n Organizmalarda
ve dolayısıyla hücrelerde en bol bulunan organik maddeler proteinlerdir. Çok
önemli bileşikler olmaları nedeniyle bunlara bu ad verilmiştir (“proteios”:
birinci)
n Yapı
ve görevle ilgili çok önemli roller üstlenirler. Hücrelerin temel organik
maddelerini oluştururlar.
PROTEİNLERİN
GÖREVLERİ
1- Enzim olarak metabolik
reaksiyonları katalizlerler. Hem hücre-içi reaksiyonlar binlerce enzim
aracılığı ile yapılır, hem de hücre-dışı olarak besinlerin sindirilmesini
sağlarlar.
2- Hücre içinde ve hücre dışı aralıklarda
yapısal bir destek oluştururlar.
Örn:Hücrenin dışında destek
görevi olanlar, bağ dokusundaki kollagen teller, kıl(saç) ve derideki keratin
gibi…
3- Hücre
içi ve hücreler arası bir çok düzenleyici fonksiyonlar
İnsülin, glukagon
gibi hormonlar…
4-Taşıma
görevi:
Proteinler
bir moleküle bağlanıp onu diğer moleküllere taşırlar.
Hücre içinde, hücre zarındaki
taşıma gibi. Hücreler arasında ve kanda oksijen ve lipidler proteinlere
bağlanarak taşınırlar.
5-Kasılma
olayı:
Kasların kasılmasında veya genel
olarak kasılmada aktin ve miyozin proteinleri görev alır.
6-Antikorlar
bağışıklık sağlayan proteinlerdir.
Bir çok
toksinler proteindir.
Proteinlerin görevleri çok fazladır. Her bir proteinin özel bir
biyolojik görevi vardır.Her bir proteinin kendine özgü bir şekli vardır.
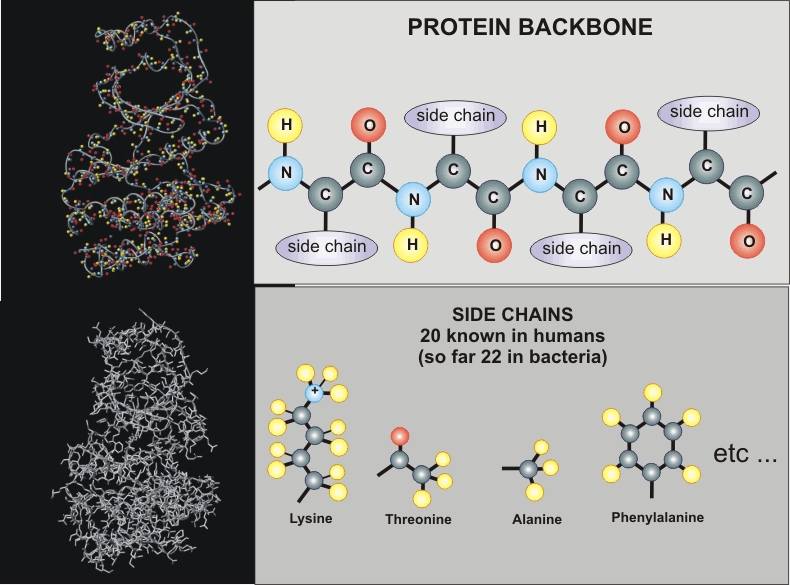
n Proteinlerin
yapısal birimi amino asitlerdir.
n Proteinler
amino asitlerin kovalent bağ ile bağlanarak meydana getirdikleri
polipeptidlerdir.
n Proteinlerin
sahip oldukları a.a. sayısı değişmektedir. 20-30’dan başlayarak birkaç yüz a.a.’lik proteinler
olabilmektedir.
n Doğal
proteinlerin yapısına giren amino asitler L-amino asitlerdir.
n Doğada
20 çeşit amino asiti vardır.
AMİNO ASİTLER
Yapılarında;
• Amino
(-NH3+) grubu
• Karboksil
(-COO-) grubu
• Yan zincir
( R )
taşıyan organik bileşiklerdir.
|
• Kısa zincirli organik asit (bir kısmı yağ asiti) lerin
türevidirler. ÖR: Asetik asit , valerik asit, Propiyonik asit, kaproik asit,
Bütirik asit…
• Proteinlerin temel yapısını oluştururlar.
• Proteinlerin temel yapısını oluştururlar
• Doğada : ~ 300
AA
• Protein
yapısında : Sadece 20 AA
•Protein yapısına katılan tüm AA’ler :
“a-AMİNO
ASİTLER”
•Aynı karbon (a)’a bağlı
COOH ve NH2
grubuna
sahiptirle
AMİNO ASİDİ GRUPLARI
n
Sahip oldukları yan gruplarındaki farklılığa
bağlı olarak gruplara ayrılmıştır.
n
Alifatik a.a.- Gly, Ala, Val, Leu, İleu
n
Hidroksilli a.a.- Ser, Thr
n
Asidik a.a- Asp, Glu
n
Amidler- Asn, Gln
n
Bazik a.a-His, Lys, Arg
n
Sülfür a.a- Cys, CysSH, Met
n
Aromatik a.a.- Phe, Try, Trp
n
İmino asitler- Pro
Glisin (Gly) G
Tüm AA ler içinde en küçük ve çok yönlü olan Glisin;
• Proteine
yapısal fleksibilite kazandırır.
• Protein
yapılarının oluşmasında
önemi büyüktür.
ALİFATİK ZİNCİRLİ AMİNO ASİTLER
GLİSİN (Gly) ALANİN (Ala)
(a-Amino propiyonik asit) ( a-Amino
asetik asit)
Prolin
(Pro) P
İmino asit?
-Yan zincirin nitrojen atomuyla kovalent bağ yaptığı siklik yapıda bir
amino asittir.
- Siklik olmasına rağmen alifatik
özelliktedir.
-Glisine zıt olarak, protein yapısında
bulunduğu yerde, yapısal fleksibiliteyi azaltır .
® Protein yapısında katı bir düzenleme sağlar.
SİSTİN
• Disülfid (kovalent) bağı içerir
• Dimerik bir amino asit
• Doğal 20 AA içinde değil
• Post-translasyonal modifikasyonla oluşur:
MODİFİYE AMİNO ASİT
• Protein zincirinde oluşan disülfid
bağları, yapıyı stabilize eder.
• Protein yapılarının oluşmasında önemli rol
oynar.
n Amino
asitlerin alfa karbon atomu diğer 4 atomla bağ yapar. C bir tetrahedronun
ortasındadır ve bağlı gruplar 4 köşeye yerleşmiştir. Eğer bu 4 grup farklı ise
(glisin hariç) iki tip konfigurasyon oluşur. Bu iki düzenleme birbirinin
aynadaki aksi gibidir. Stereoizomer olarak adlandırılır.
n D
ve L konfigurasyonları
n Amino
asitleri α pozisyonundaki H
yerine amino grubu yerleşmiş olan organik asitlerdir.
n Örn:
Asetik asit’ten (CH3COOH) oluşan glisin, propiyonik asit’ten (CH3CH2COOH)
oluşan alanin
n Her
amino asitinde en az bir amino grubu (-NH2), bir de karboksil grubu (-COOH)
bulunur. Bu gruplar α karbon
denilen tek bir C atomu ile birbirinden ayrı bulunurlar. Karboksil grubu
asidik, amino grubu ise bazik bir gruptur.
n Asidik
grup bir proton (hidrojen iyonu) veren
n Bazik
grup bir proton alan
n Bu
karbona yan gruplar da bağlanır.
n Bir
a.a.’nın kimyasal yapısını R ile gösterilen radikal grup tayin eder.
n Amino
asitlerin birbirlerine göre farklılıkları yan gruplarından kaynaklanır.
n Doğada
20 çeşit a.a. olduğuna göre 20 çeşit R grubu vardır.
n En
basit a.a. Glisin’dir.
R grubu tek
bir hidrojenden oluşur.
Yan gruplar tek bir hidrojen
atomundan kompleks zincirler ve halkalar şekline kadar değişir.
n Yan
zincirlerin özelliği , bir protein molekülünün özelliğini ve onu diğer
proteinlerden ayıracak fonksiyonunu belirler.
PEPTİD BAĞI
* Bir amino
asitin α-karboksilinin,
ikinci bir aminoasitin α-amino
grubuna bağlanması ile peptid bağı oluşur (Prolinde imino grubu).
* Her birleşme
yerinden bir su molekülü ortaya çıkar.
Oluşan yeni yapının bir ucunda
daima bir amino grubu, diğer ucunda bir karboksil grubu vardır. Böylece polipeptid
zincirleri oluşur.
n Molekülün
karboksil ucuna C-terminal, amino ucuna N-terminal denir.
PROTEİNLERİN ÜÇ
BOYUTLU YAPISI
n Proteinleri
yapılarına göre sınıflandırmada X ışınları saptırması tekniğinden faydalanılır.
n Protein
moleküllerini meydana getiren a.a. dizilerinin uzaydaki duruşuna bağlı olarak,
proteinler 4 farklı çeşit yapı göstermektedir.
n Primer
yapı
n Sekonder
yapı
n Tersiyer
yapı
n Kuaterner
yapı
PRİMER YAPI
n Amino
Asitlerin peşpeşe spesifik bir şekilde dizilişinden oluşan polipeptid zinciri
primer yapıyı oluşturur.
n Primer
yapı hat şeklinde bir yapıdır. Bu yapıda a.a.’lerinin hangi sıraya göre
dizileceği protein olarak bulunduğu organizmanın kalıtımında bulunur.
n DNA
a.a. dizilişindeki bilgiyi sağlar. Amino asidi dizilişi o proteinin yapısı için
gerekli olan bilgiyi sağlar.
n Proteini
oluşturan amino asitlerinin dizilişi DNA dizi analizi yöntemi ile
belirlenmektedir.
n Her
protein için belli ve tek bir a.a. dizisi bulunmaktadır.
n Bu
a.a. dizisi türe özgüldür. Organ veya dokuya özgü de olabilir.
n Sekonder
ve tersiyer yapının meydana gelmesinde primer yapı rol oynar.
n Primer
yapısı incelenmiş proteinlerden biri ribonükleaz enzimidir. Bu enzimde 124
amino asidi vardır.
Molekül
ağırlığı 13 700 Daltondur.
Zincir üzerinde sistein kökleri
arasında dört disülfit bağı ile köprüler meydana getirilmiştir.
n Bir
proteinde tek bir a.a. dizilişinin yer değiştirmesi çok önemli biyolojik
değişmelere yol açabilir.
n Polipeptid
zinciri Hidrojen bağları sayesinde kararlı bir haldedir. H- bağı zayıf bağlar
olmasına karşın çok sayıda bulunduğunda yapıya sağlamlık kazandırır.
n Peptid
bağları enerji gerektiren kompleks reaksiyonlar sonucunda meydana gelir.
n Protein
sentezi sitoplazma içerisinde ribozomlarda oluşur. Ribozomlarda proteinler
sentezlenirken yeni a.a.’ler daima
C-terminal ucuna eklenir.
n Hücre
içerisinde serbest bulunan amino asitleri bir havuz oluşturur. Hücre bunları
kullanarak ihtiyacı olduğu proteini sentezler.
SEKONDER YAPI
n C-N
bağının katlanmaya karşı direnci vardır. Protein molekülü içerisindeki protein
molekülünün katlanması yerine sadece alfa karbonlara bağlı yan gruplar
dönebilir. Bu rotasyon da sınırlıdır. Ancak alfa-heliks ve beta yapısında
rasgele sarmal şekilli polipeptid zincirleri meydana gelir.
n Alfa
heliks yapıda polipeptid zinciri sanki bir silindirin çevresinde kıvrılmış
gibidir. Zincirin iskeleti iç taraftadır. Yan zincirler dışarı doğrudur.
Heliksin her tam dönüşüne giren mesafeye 3.6 amino asidi girer. Böylece her 4.
a.a birbirine yaklaşır ve aralarında hidrojen bağları oluşur.
n Karbonil
ve amid gruplarının pozisyonu H- bağı kurmak için en uygun pozisyonu
oluşturmaktadır. Yapı kararlı olmaktadır.
n Beta
yapısı veya beta tabakalarında birbirine paralel uzanan iki zincir yan yana
pilili gibi katlanmış bir yassı tabaka halinde bulunurlar. İki zinciri bir
arada tutan hidrojen bağları uzun eksene dik olarak yer almış, yan gruplar yan
zincirler halinde bu yapıya dikey olarak bağlanmıştır.
n Alfa
heliks keratin sınıfı proteinlerin bir özelliği, beta yapısı ipek
proteinlerinde bulunur.
n Fibröz
proteinler globüler proteinlere çok daha düzenli bir sekonder yapıya sahiptir.
n Globüler
proteinler tek bir sekonder yapı göstermezler.Molekülün bir kısmı alfa heliks
yapısı, diğer kısmı ise beta tabaka yapısı gösterebilir.
n Globüler
proteinler polipeptid zincirinin aşırı katlanması nedeniyle sıkışık bir yapıya
sahiptir
TERSİYER YAPI
n Globüler
veya küresel proteinler tersiyer yapıdadır.
n Polipeptid
zinciri daha kompleks bir şekilde bükülmüş ve uzaydaki duruşu çok karışık bir
hal almıştır.
n Sekonder
yapıda yalnızca yan yana a.a. ‘ler arasında konformasyon söz konusudur.
n Tersiyer
yapıda ise, bütün protein molekülünün konformasyonu tersiyer yapıyı oluşturur.
n Zincirde
birbirine uzak iki a.a. birbirine yaklaşır. Zincirin farklı yerlerindeki R
grupları arasında eşit interaksiyonlar meydana gelir. Bir proteinin kendine has
dizilişteki a.a.’leri o proteine has bir konformasyona yol açar. Hem hidrojen
bağları hem de enine bağlarla bağlanmış olan zincir viskoz bir protein molekülü
meydana getirir.
n Proteinlerin
3 boyutlu yapılarında önemli noktalar
n 1-
Globüler proteinler polipeptid zincirinin aşırı katlanması nedeniyle sıkı bir
yapıya sahiptir.
n 2-Miyoglobin,
lizozim ve ribonükleazın katlanmış yapılarında,yüzeydeki yapılar genellikle
polar gruplar taşır. Solventle etkileşimde bulunmayan non-polar gruplar
molekülün iç kısmında yer alır.
KUATERNER YAPI
n Sekonder
ve tersiyer yapıları kapsayan birimlerin biraraya gelmesiyle ortaya çıkan
yapıdır. Kuaterner yapıda ikiden fazla polipeptid zinciri bulunur. Zincirler
birbirlerine zayıf bağlarla bağlanmıştır. Hemoglobin dört polipeptid
zincirinden oluşmuş kuaterner yapılı bir proteindir.
PROTEİNLERİN BAĞLARI
n Primer
yapılarda daima kovalent bağlar (peptid bağları) vardır.
n Disülfit
bağları da kovalent bağlar olup, iki sistein yan zincirinin –SH grupları
arasında –S-S- köprüleri şeklinde oluşur.
Disülfid Bağ Oluşumu
n Yüksek
ısı, yüksek basınç, asitlik gibi etkilerle yani uygun olmayan fizyolojik
şartlarda proteinlerin zincir yapısı bozulur. Disülfit bağları çözülür. Buna
denatürasyon denir. Etki hafif ise, normal şartlara dönüşte, yapı eski halini
alır. Buna da renatürasyon denir Etki şiddetli ise geriye dönüş olmaz.
Molekülün yapısı bozulur. Böylece biyolojik aktivitesi de bozulur.
n Disülfit
bağları redükleyici madelerle (merkaptoetanol, DDT gibi) reversibl olarak
çözülür.
n Proteinlerin
sekonder ve tersiyer yapıları zayıf interaksiyonlarla oluşur. İyonik veya
elektrostatik bağlar meydana gelir. Hidrojen bağları önemli bağlardır.
n Kovalent
olan veya olmayan bağlar arasındaki fark bu bağların koparılmaları için gereken
enerjidedir.
n Kovalent
bağın koparılması için 110 kcal/mol enerji gerekir. Hidrojen bağını koparmak
için 4.5 kcal/mol enerji yeterlidir. Kovalent bağları koparmak için enzimler
gerekir.Kovalent olmayan diğer bağlar ise fizikokimyasal kuvvetlerle koparılır.

Hiç yorum yok:
Yorum Gönder